胰导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)是一种预后极差的恶性肿瘤,恶性程度高,病程短,发展和恶化速度快,治疗效果不理想,因此被称为“癌王”。目前胰腺癌的治疗尚无特效药物。胰腺癌患者中,存在可干预分子改变的患者约占所有胰腺癌的12%-25%,靶向治疗潜在受益人群约25%,其中可接受靶向治疗的患者只有2%左右,且靶向治疗效果对于胰腺癌患者的生存期提高非常有限。同时,目前常用的PD-1/L1等抗体药在胰腺癌上同样收获甚微,其疫苗及细胞免疫疗法在胰腺癌的临床试验也均处于早期阶段。因此,发现新的有效治疗胰腺癌的分子靶点并研发创新药物具有重要的临床意义。
近日,我校科技部/教育部细胞调控与分子药物“111”引智基地、发酵工程教育部重点实验室、教育部工业发酵省部共建协同创新中心、工业微生物湖北省重点实验室唐景峰/周策凡课题组在Nture子刊Signal Transduction and Targeted Therapy(简称STTT,IF=38.104)发表了题为“B-lymphoid tyrosine kinase mediated FAM83A phosphorylation elevates pancreatic tumorigenesis through interacting with β-catenin”的科研成果(https://www.nature.com/articles/s41392-022-01268-5)。我校为成果署名第一单位,唐景峰教授为通讯作者,周策凡副教授为第一作者。该研究得到国家自然科学基金项目(32070726、82273970、32270768、31871176)、湖北省杰出青年基金项目(2020CFA073)、湖北省重点研发项目(2022EHB038)、武汉市科技计划项目(2019020701011475)等经费资助。本科研成果历时5年,课题组紧紧围绕胰腺癌治疗关键信号调控通路及药物靶点开展研究,发现了一种新的具备核质分布的β-catenin相互作用蛋白FAM83A对胰腺癌发生进程调节非常重要,阐明了FAM83A调控胰腺癌重要信号通路-Wnt/β-catenin的作用机制,筛选并获得了多个靶向FAM83A-β-catenin的阻断短肽药物前体,并在斑马鱼、小鼠等动物模型验证了其作用效果,表明该短肽药物前体具有很好的临床药物转化前景,成果已申请了国家发明专利。硕士研究生朱霄婷、刘南茜为共同第一作者。本项成果的合作单位还有复旦大学、加拿大阿尔伯塔大学、武汉大学、宁夏医科大学等单位。

胰腺癌的形成主要是由一系列基因突变的积累及多条信号通路异常协同作用导致。从胰腺上皮细胞瘤样病变不典型增生(PanIN-1和PanIN-2)发展到原位癌(PanIN-3),最后形成具有侵袭性的肿瘤,这整个过程除了包含了前期原癌基因Kras的激活突变,中后期抑癌基因CDKN2A(编码INK4A抑制剂)、TP53的失活突变和SMAD4/DPC4的基因丢失等之外,还伴随着Wnt/β-catenin等多条信号通路的异常激活。Wnt/β-catenin信号通路在调节细胞自我更新、细胞增殖、分化与凋亡、胚胎发育、组织稳态及细胞癌变等方面均发挥着重要的作用。各种致癌因素或者原癌基因导致的经典Wnt/β-catenin通路中的相关靶基因过表达,会导致游离的β-catenin在细胞内大量聚集,并通过核转位现象入核,与转录因子T细胞因子/淋巴增强因子复合物(TCF/LEF)结合,激活Wnt/β-catenin信号转导通路的下游相关靶基因Cyclin D1、C-myc等的异常转录,调控基因表达,影响细胞的正常分化和发育,最终导致细胞癌变。
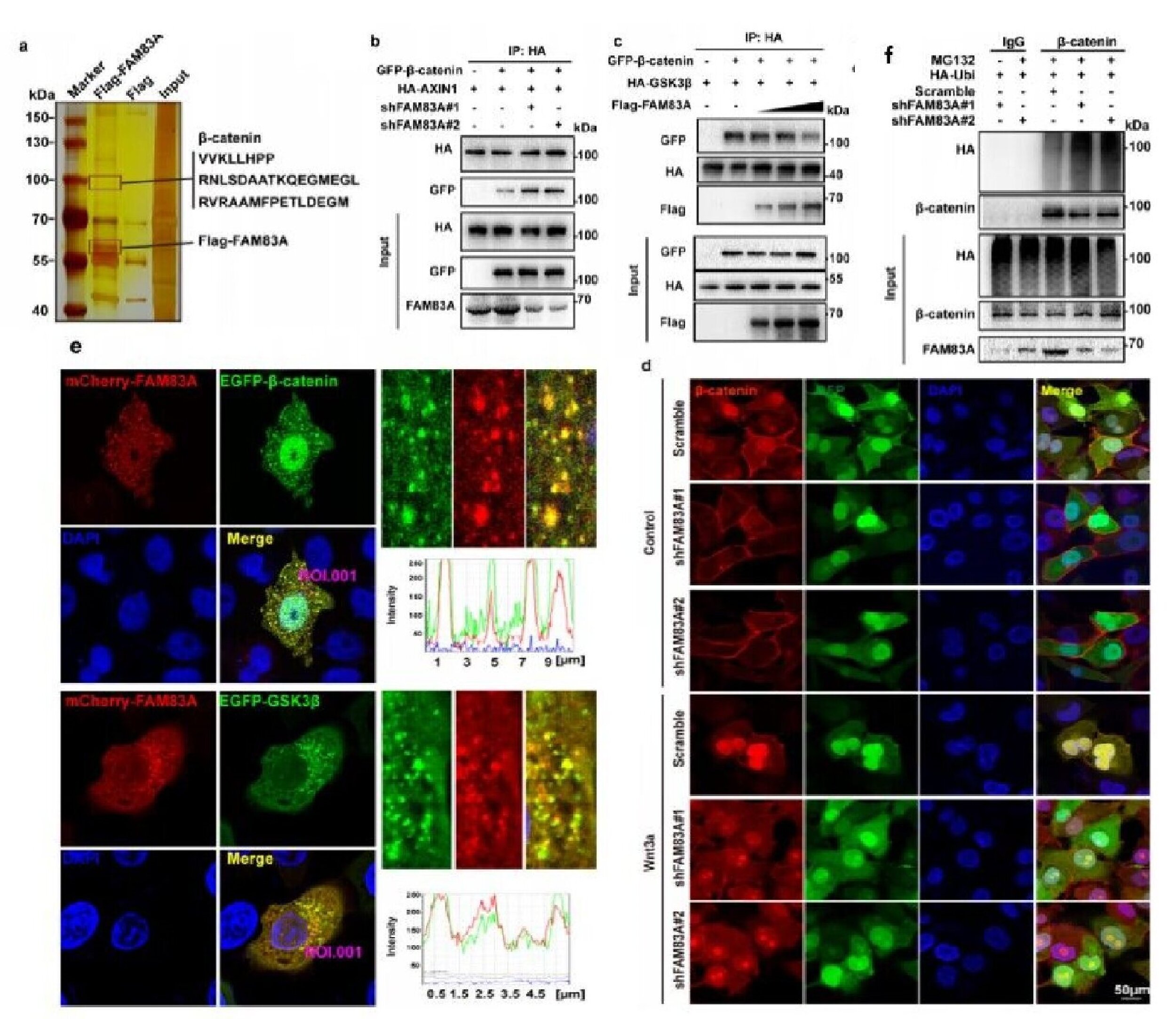
图1.FAM83A与β-catenin直接结合,并抑制降解复合体的组装,从而抑制β-catenin的磷酸化和降解
该研究鉴定了一种新的具备核质分布的β-catenin相互作用蛋白FAM83A,并证明了FAM83A是Wnt/β-catenin信号通路的正向调节因子。同时,研究者们阐明了FAM83A调控Wnt通路的两种机制:1)细胞质中,FAM83A能够作用并抑制β-catenin降解复合体的组装,从而抑制β-catenin与β-TrCP的结合,进而调控β-catenin蛋白的磷酸化和降解。在此基础上进一步发现FAM83A蛋白中DUF1669结构域介导该相互作用,并发现该结构域上的酪氨酸138残基(Y138)能够被SRC非受体激酶家族成员BLK激酶磷酸化。此外,FAM83A酪氨酸138磷酸化能够强化其在细胞质中的功能;2)细胞核中,FAM83A能够与TCF4结合,抑制组蛋白乙酰化水平,进而调控Wnt靶基因的转录。同时,FAM83A Y138位点磷酸化后表现出明显的核易位升高。该位点的磷酸化显著促进其与β-catenin/TCF4复合体的结合,增强Wnt/β-catenin介导的转录及致癌效果。
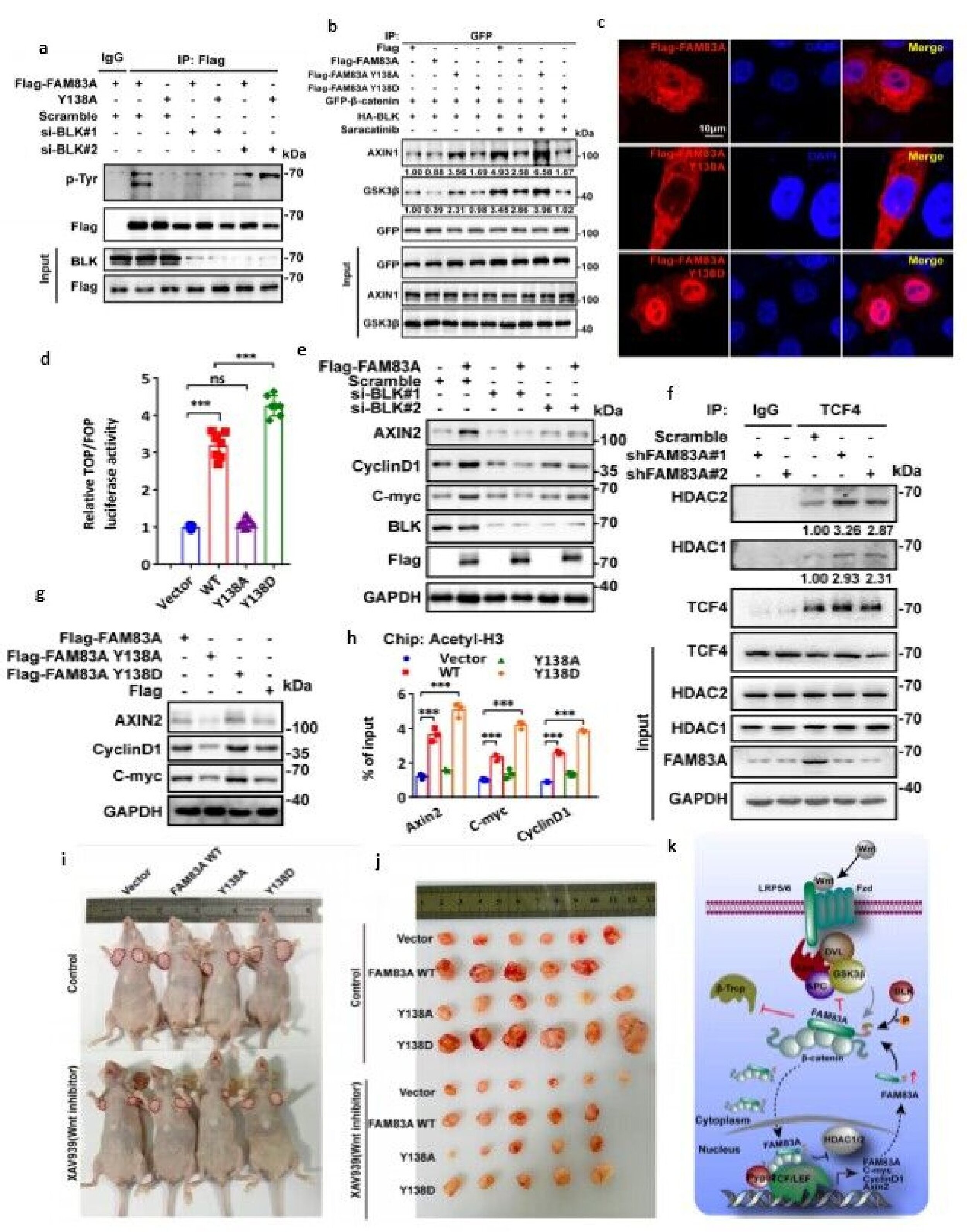
图2.BLK磷酸化FAM83A Y138残基,磷酸化的FAM83A抑制β-连环蛋白破坏复合体组装和TCF4对HDAC的招募。
另外,科研团队还在FAM83A基因启动子区找到Wnt/β-catenin通路典型的TBE结合位点(TCF/LEF binding elements)。当Wnt3a刺激后,TCF4、β-catenin在该位点的富集明显增多,FAM83A的表达水平明显提高,证明了FAM83A是Wnt/β-catenin信号通路的直接下游靶点,与Wnt/β-catenin信号通路形成一种正向调节回路。
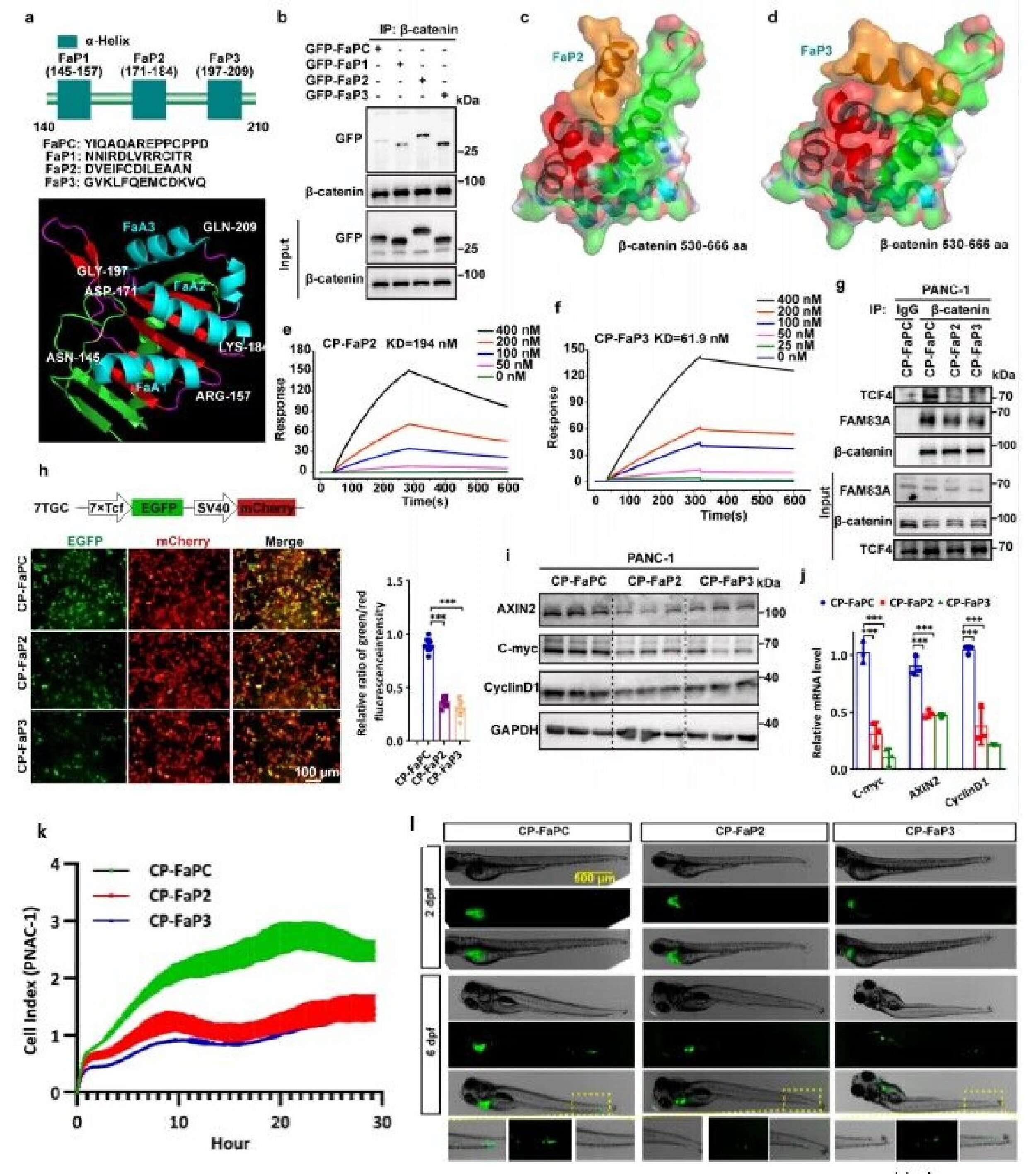
图3.靶向FAM83A-β-catenin相互作用的抑制肽在体内外均能显著抑制胰腺癌的生长和转移
胰腺癌上市药物中化疗药物占比达78%,分子靶向药仅占22%。针对胰腺癌开发的药物类型多样,小分子和单抗数量最多,分别占比43.2%和25.9%,加和比重近70%。细胞疗法、溶瘤病毒、寡核苷酸等新型药物也有所涉及。值得关注的是,研究者们根据FAM83A与β-catenin特异性相互作用结构区间,设计并筛选了一系列能够靶向该互作的关键阻断短肽,同时在细胞、小鼠和斑马鱼模型中证明了该系列多肽靶向药物对胰腺癌生长、迁移和侵袭能力的抑制作用,表明了针对胰腺癌中Wnt通路调控的短肽类药物在胰腺癌治疗中的转化应用前景。